- 產(chǎn)地
- 蘇州
- 品牌
- 外泌體提取試劑
- 型號
- 齊全
- 是否定制
- 是
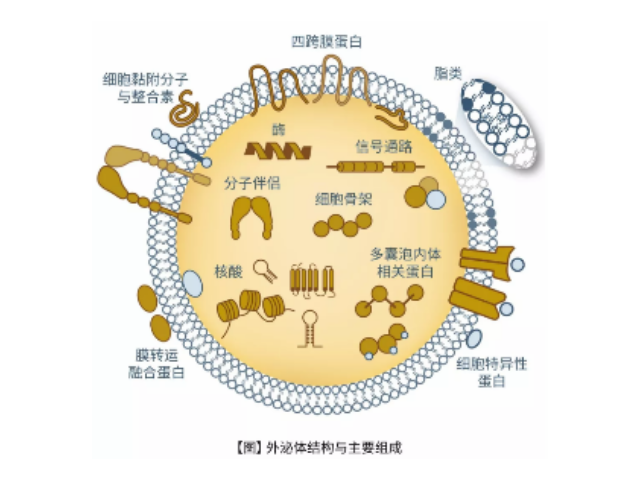
腦組織分離方法簡述:將腦組織剪成薄片,放入離心管中加上消化液進行消化,經(jīng)水浴、反復輕輕上下顛倒,再用移液間斷緩慢吹吸至消化結束。隨后加入培養(yǎng)基于消化液中,混勻,置于冰上。再進行一系列的差速超速離心過程,包括除雜、濾膜過濾、超離等。較后用PBS重懸外泌體,用重懸后的外泌體進行下面的透射電鏡(TEM)、納米粒徑追蹤分子(NTA)和markerWB鑒定。外泌體(Exosomes)是細胞分泌到胞外的一種囊泡(ExtracellularVesicles,EVs),其大小為30-150nm,具有雙層膜結構和茶托狀形態(tài),含有豐富的內(nèi)含物(包括核酸、蛋白和脂質(zhì)等),參與細胞間的分子傳遞。外泌體普遍存在于細胞培養(yǎng)上清以及各種體液中,包括血液、唾液、尿液、、乳汁等,同時也存在于組織樣本中,如腦組織、肌肉組織、脂肪組織等。用于外泌體提取的體液收集注意事項:避免劇烈搖晃。徐州外泌體提取試劑單價

外泌體研究的主要應用:外泌體的功能取決于其所來源的細胞類型,其可參與到機體免疫應答、抗原提呈、細胞遷移、細胞分化、一些病癥侵襲等方方面面。有研究表明一些病癥來源的外泌體參與到一些病癥細胞與基底細胞的遺傳信息的交換,從而導致大量新生血管的生成,促進了一些病癥的生長與侵襲。一些病癥。一些病癥轉移。來自白血病干細胞的外泌體促進急性骨髓性白血病(AML)細胞的增殖、遷移和壓制細胞凋亡。治病靶標。利用外泌體遞送小干擾RNA來沉默KRASG12D,從而特異性高效靶向至胰腺病細胞,以明顯降低RAS活化、病細胞增殖和轉移過程。免疫。β細胞將含有蛋白質(zhì)和miRNA的外泌體釋放到細胞外,并可轉移到其他代謝部位或免疫內(nèi)皮細胞,有利于維持葡萄糖體內(nèi)平衡或造成胰島素抵抗。心血管。外泌體介導miR-155從平滑肌細胞轉移到內(nèi)皮細胞導致了內(nèi)皮細胞的損傷促進動脈硬化。分子標記。疾病診斷。在酒精性肝病、NASH、菌類性肝炎、藥物性肝損傷和肝細胞病中發(fā)現(xiàn)循環(huán)EVs的水平上升重慶外泌體提取試劑直銷價色譜法。這種方法分離到的外泌體在電鏡下大小均一,但是需要特殊的設備,應用不普遍。

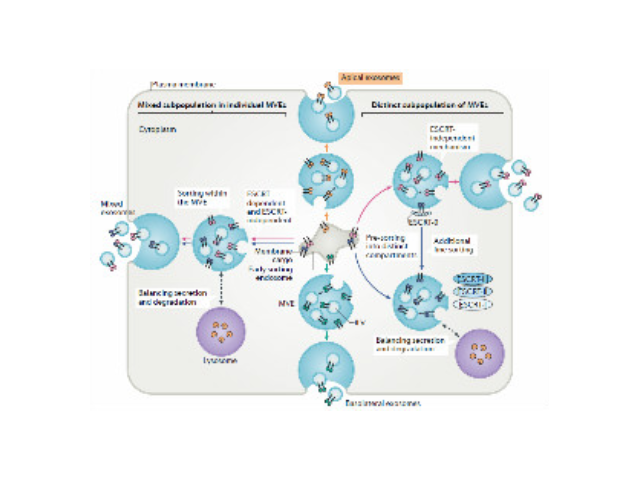
1983年,外泌體初次于綿羊網(wǎng)織紅細胞中被發(fā)現(xiàn),1987年Johnstone將其命名為“exosome”。多種細胞在正常及病理狀態(tài)下均可分泌外泌體。其主要來源于細胞內(nèi)溶酶體微粒內(nèi)陷形成的多囊泡體,經(jīng)多囊泡體外膜與細胞膜融合后釋放到胞外基質(zhì)中。所有培養(yǎng)的細胞類型均可分泌外泌體,且外泌體天然存在于體液中,包括血液、唾液、尿液、腦脊液和乳汁中。有關他們分泌和攝取及其組成、“運載物”和相應功能的精確分子機制剛剛開始研究。外泌體目前被視為特異性分泌的膜泡,參與細胞間通訊,對外泌體的研究興趣日益增長,無論是研究其功能還是了解如何將其用于微創(chuàng)診斷的開發(fā)。
為了分離外泌體,研究人員用兩個這樣的單元串聯(lián)構建了一個裝置。首先,使用聲波從血液樣品中除去細胞和血小板。一旦細胞和血小板被去除,樣品進入第二個微流體單元,然后使用較高頻率的聲波將外泌體與稍大的細胞外囊泡分開。這項工作的通訊作者之一,麻省理工學院材料科學與工程系科學家MingDao博士說:“聲波更溫和。而且在分離時,這些囊泡受處理的時間只有1秒鐘或更短。這是一個很大的優(yōu)勢。”使用該設備,處理100微升未稀釋血液樣本只需要不到25分鐘。“這種新技術可以解決當前外泌體分離技術的缺點,如周期長,一致性差,產(chǎn)量低,污染以及完整性受損等。我們想要把提取高質(zhì)量的外泌體的過程簡化為按一個按鈕就在10分鐘內(nèi)獲得所需樣品一樣簡單。”研究人員們說。機械力或者吐溫-20等化學添加物將會破壞外泌體等,因此發(fā)表文章時易受質(zhì)疑。
研究表明被特定部位的細胞獲取的一些病癥外泌體可為一些病癥的轉移準備轉移前微環(huán)境。用肺轉傾向的一些病癥細胞來源的外泌體處理小鼠后可使骨轉傾向的一些病癥細胞重新定向。外泌體的蛋白質(zhì)組學分析發(fā)現(xiàn)不同部位傾向性的一些病癥細胞來源的外泌體具有不同的整合素(integrin)表達譜,整合素α6β4和α6β1與肺轉有關,而整合素αvβ5與肝轉有關。敲低整合素α6β4和αvβ5可減少外泌體被靶部位細胞獲取,進而分別降低了肺和肝的轉移。進一步研究發(fā)現(xiàn)外泌體整合素被細胞獲取后啟動了Src的磷酸化和促炎的S100基因的表達。較后通過臨床數(shù)據(jù)分析顯示外泌體整合素可作為預測一些病癥轉移的部位傾向性的診斷指標。外泌體提取:免疫分離技術。貴陽外泌體提取試劑服務電話
外泌體提取:可用于收集大于800nm、400nm或200nm的外泌體。徐州外泌體提取試劑單價
密度梯度離心法該方法由于比較繁瑣,用的較少。原理是:像所有的脂質(zhì)小囊泡一樣,外泌體可以懸浮于特定密度梯度的蔗糖中,其密度范圍1.13g/ml-1.21g/ml,將要分離外泌體的樣本液體置于梯度蔗糖介質(zhì)上,隨后通過離心將外泌體分離。此法獲得的外泌體純度較高,但步驟繁瑣,耗時,對離心時間極為敏感。具體步驟是:收集培養(yǎng)2d的上清液。將培養(yǎng)上清液先以1500r/min離心5min除去細胞及碎片,再依次以1000×g離心10min取上清,10000×g離心30min取上清,然后用100ku超濾離心管(Millipore)濃縮至15mL,徐州外泌體提取試劑單價
作為一種分子通斷開關的KRAS發(fā)生突變時會處于“開啟”狀態(tài)。在80%~95%的胰腺導管腺病(PDAC)當中,這個基因發(fā)生突變,這也是這種一些疾病中較為常見的突變。這些研究人員證實iExosome能夠運送特異性地靶向KRAS的siRNA和shRNA分子,并且比他們的合成對應物脂質(zhì)體(liposome)更加高效。脂質(zhì)體不具有外泌體表現(xiàn)出的天然復雜性和優(yōu)勢。德州大學MD安德森一些疾病中心一些疾病生物學助理教授ValerieLeBleu博士說,“我們的研究提示著與脂質(zhì)體相比,外泌體表現(xiàn)出運送siRNA分子和壓制侵襲性胰腺瘤生長的優(yōu)異能力。我們也證實外泌體表面上的CD47存在允許它們躲避來自循環(huán)單核細胞...
- 徐州外泌體提取試劑單價 2025-07-15
- 武漢正規(guī)外泌體提取試劑廠家 2025-07-15
- 貴陽外泌體提取試劑哪里買 2025-07-15
- 廣州正規(guī)外泌體提取試劑產(chǎn)品介紹 2025-07-15
- 南京外泌體提取試劑單價 2025-07-14
- 唐山外泌體提取試劑供應商 2025-07-14
- 南昌正規(guī)外泌體提取試劑廠家 2025-07-14
- 寧波外泌體提取試劑廠家直銷 2025-07-14
- 武漢正規(guī)外泌體提取試劑哪里買 2025-07-14
- 南昌外泌體提取試劑供應商 2025-07-14
- 北京外泌體提取試劑供應商 2025-07-14
- 重慶正規(guī)外泌體提取試劑生產(chǎn)廠家 2025-07-14
- 長沙外泌體提取試劑產(chǎn)品介紹 2025-07-14
- 貴陽外泌體提取試劑產(chǎn)品介紹 2025-07-13
- 珠海外泌體提取試劑哪家便宜 2025-07-13
- 杭州外泌體提取試劑價格 2025-07-13


- 南昌正規(guī)細胞外基質(zhì)膠廠家推薦 07-15
- 武漢正規(guī)外泌體提取試劑廠家 07-15
- 開封細胞外基質(zhì)膠價格 07-15
- 貴陽外泌體提取試劑哪里買 07-15
- 唐山細胞外基質(zhì)膠單價 07-15
- 廣州正規(guī)外泌體提取試劑產(chǎn)品介紹 07-15
- 南京外泌體提取試劑單價 07-14
- 唐山外泌體提取試劑供應商 07-14
- 南昌正規(guī)外泌體提取試劑廠家 07-14
- 石家莊正規(guī)細胞外基質(zhì)膠哪家便宜 07-14