長(zhǎng)沙正規(guī)外泌體提取試劑廠家
- 產(chǎn)地
- 蘇州
- 品牌
- 外泌體提取試劑
- 型號(hào)
- 齊全
- 是否定制
- 是
外泌體與肺病預(yù)后:外泌體mirRNA和蛋白質(zhì)被認(rèn)為是NSCLC的預(yù)后因子。Dejima等在研究NSCLC患者預(yù)后的生物標(biāo)志物時(shí)發(fā)現(xiàn),外泌體miR-4257和miR-21的含量顯著上升。此外,還有研究表明,低水平miR-146a-5p的NSCLC患者較高水平miR-146a-5p的NSCLC患者有更高的復(fù)發(fā)率。Sandfeld-Paulsen等在研究276例NSCLC患者血漿的外泌體時(shí)發(fā)現(xiàn),NY-ESO-1是其中對(duì)低生存率有顯著影響的標(biāo)志物。Silva等利用TaqMan低密度芯片的方法系統(tǒng)分析了28位NSCLC患者體內(nèi)的365種miRNA,其中l(wèi)et-7f、miR-30e-3p和miR-20b表達(dá)均下調(diào),進(jìn)一步研究發(fā)現(xiàn)。外泌體提取:重復(fù)離心操作還有可能對(duì)囊泡造成損害,從而降低其質(zhì)量。長(zhǎng)沙正規(guī)外泌體提取試劑廠家
外泌體的生物學(xué)功能研究中需要分離完整的外泌體顆粒,而傳統(tǒng)超速離心方法步驟繁瑣、硬件要求高、操作難度大。李記生物自主開(kāi)發(fā)的外泌體快速提取試劑盒,組分經(jīng)過(guò)優(yōu)化處理,適用于細(xì)胞培養(yǎng)上清液、血清、血漿、尿液及其他體液(腦脊液、腹水、羊水、乳汁以及唾液等)中的外泌體提取,并搭配純化過(guò)濾裝置,可快速高效地獲得高純度外泌體顆粒。注意事項(xiàng):1.對(duì)于待測(cè)樣品粘度過(guò)大時(shí),可將樣本用4℃預(yù)冷的1×PBS緩沖液進(jìn)行等體積稀釋處理。2.當(dāng)血清、血漿、唾液等樣品收獲的外泌體濃度較高,收獲的外泌體顆粒無(wú)法通過(guò)EPF柱純化時(shí),可用4℃預(yù)冷的1×PBS進(jìn)行稀釋后再通過(guò)EPF柱離心。3.針對(duì)外泌體標(biāo)志蛋白(CD63,CD9,CD81等)進(jìn)行Westernblot檢測(cè),可以鑒定所提的外泌體。通過(guò)超速離心(120000g/分鐘)20小時(shí)以上才能獲得足夠的外泌體量長(zhǎng)沙正規(guī)外泌體提取試劑廠家所有培養(yǎng)的細(xì)胞類(lèi)型均可分泌外泌體,且外泌體天然存在于體液中,包括血液、唾液、尿液、腦脊液和乳汁中。
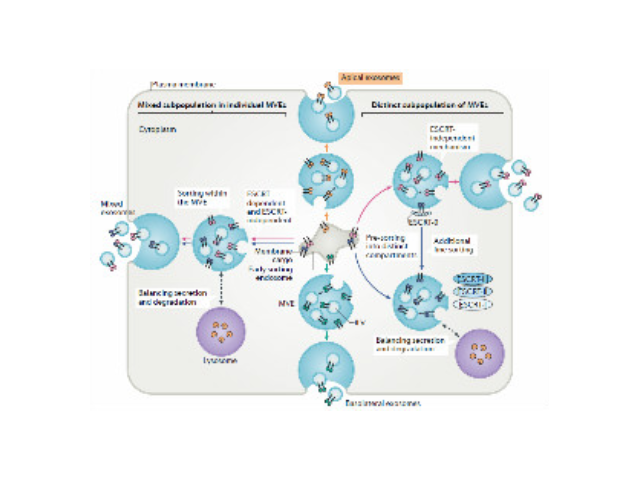
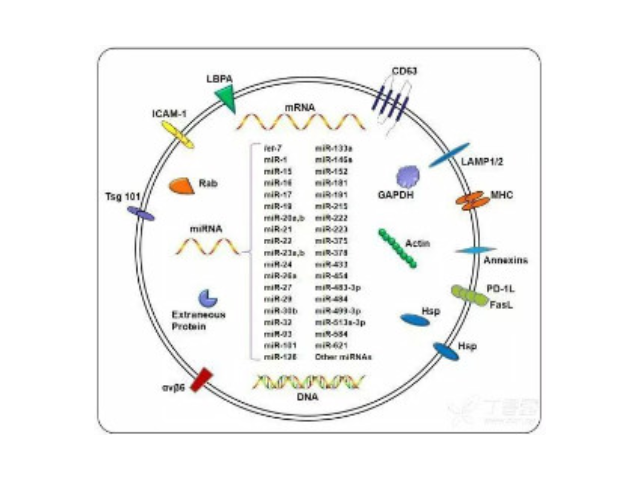
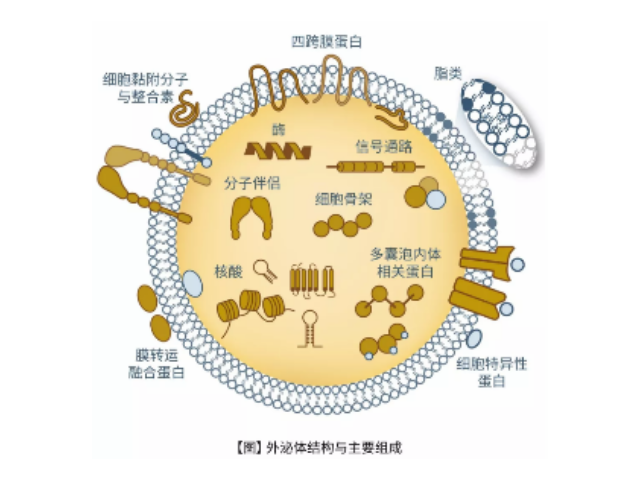
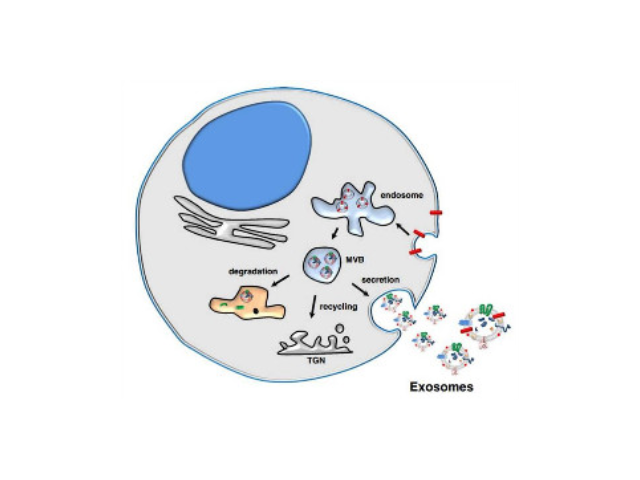
外泌體的形成與鑒定:首先,細(xì)胞膜內(nèi)陷形成一個(gè)杯狀結(jié)構(gòu),包括細(xì)胞表面蛋白和與細(xì)胞外環(huán)境相關(guān)的可溶性蛋白,導(dǎo)致早期胞內(nèi)體(early-sortingendosome,ESE)的從頭形成,或者是杯狀結(jié)構(gòu)直接和已經(jīng)存在的ESEs融合;trans-高爾基體和內(nèi)質(zhì)網(wǎng)也能協(xié)助形成ESEs。ESE成熟后形成晚期胞內(nèi)體(late-sortingendosomes,LSEs),較終形成MVBs(也稱(chēng)為多囊內(nèi)小體)。MVBs是通過(guò)endosome限制膜向內(nèi)凹(即質(zhì)膜雙凹)形成的,這一過(guò)程導(dǎo)致MVBs含有多個(gè)ILVs。MVB可以與溶酶體或自噬體融合,較終降解或與質(zhì)膜融合釋放作為外泌體的ILVs。外泌體表面蛋白包括四聚體蛋白、整合蛋白、免疫調(diào)節(jié)蛋白等。外泌體可以包含不同類(lèi)型的細(xì)胞表面蛋白、細(xì)胞內(nèi)蛋白、RNA、DNA、氨基酸和代謝物。使用可截留100KD分子量的膜,通過(guò)離心截留上清中的外泌體,截留完成后。
人體幾乎所有類(lèi)型的細(xì)胞都能分泌外泌體,外泌體普遍存在并分布于各種體液中,攜帶多種蛋白質(zhì)、mRNA、miRNA和脂質(zhì)類(lèi)物質(zhì)等,作為重要的傳遞信號(hào)分子,形成了一種全新的細(xì)胞-細(xì)胞間信息傳遞系統(tǒng),可參與細(xì)胞通訊、細(xì)胞遷移、血管新生和一些病癥細(xì)胞生長(zhǎng)等過(guò)程。外泌體與微泡:我們知道,細(xì)胞間相互作用可以通過(guò)釋放蛋白質(zhì)、核酸、脂質(zhì)等分子到胞外與受體結(jié)合從而介導(dǎo)胞內(nèi)細(xì)胞傳導(dǎo)。除此之外,細(xì)胞還可以釋放膜囊泡,外泌體與微泡就是其中兩種,二者相似但形成方式不同:外泌體是細(xì)胞內(nèi)內(nèi)溶酶體微粒內(nèi)陷形成的多囊泡體,經(jīng)多囊泡體外膜與細(xì)胞膜融合后釋放到胞外基質(zhì)中的膜囊泡,而微泡則是細(xì)胞出芽與細(xì)胞膜融合后直接脫落形成的囊泡,且外泌體大小均一,直徑在40~100nm,其大小取決于其起源部位以及細(xì)胞中的脂質(zhì)雙層結(jié)構(gòu);而微泡大小不一,直徑在50~1000nm之間。唐山正規(guī)外泌體提取試劑產(chǎn)品介紹在超速離心力作用下,使蔗糖溶液形成從低到高連續(xù)分布的密度階層,是一種區(qū)帶分離法。一方面可以作為診斷多種疾病的生物指標(biāo)。
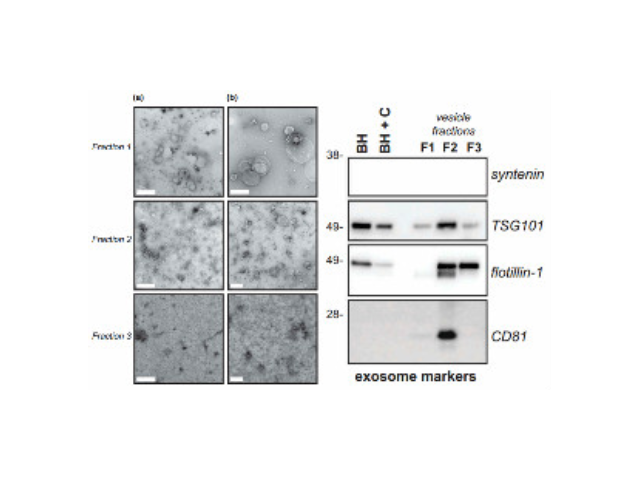
人體內(nèi)多種細(xì)胞及體液均可分泌外泌體,包括內(nèi)皮細(xì)胞、免疫細(xì)胞、血小板、平滑肌細(xì)胞等。當(dāng)其由宿主細(xì)胞被分泌到受體細(xì)胞中時(shí),外泌體可通過(guò)其攜帶的蛋白質(zhì)、核酸、脂類(lèi)等來(lái)調(diào)節(jié)受體細(xì)胞的生物學(xué)活性。外泌體介導(dǎo)的細(xì)胞間通訊主要通過(guò)以下三種方式:一是外泌體膜蛋白可以與靶細(xì)胞膜蛋白結(jié)合,進(jìn)而啟動(dòng)靶細(xì)胞細(xì)胞內(nèi)的信號(hào)通路。二是在細(xì)胞外基質(zhì)中,外泌體膜蛋白可以被蛋白酶剪切,剪切的碎片可以作為配體與細(xì)胞膜上的受體結(jié)合,從而啟動(dòng)細(xì)胞內(nèi)的信號(hào)通路。有報(bào)道稱(chēng)一些外泌體膜上蛋白在其來(lái)源細(xì)胞膜上未能檢測(cè)出。三是外泌體膜可以與靶細(xì)胞膜直接融合,非選擇性的釋放其所含的蛋白質(zhì)、mRNA以及microRNA。外泌體提取:尺寸排阻色譜。尺寸排阻色譜是基于大小而非分子量實(shí)現(xiàn)分離大分子。重慶外泌體提取試劑哪家便宜
靜置10~15分鐘,留取沉淀物備用。長(zhǎng)沙正規(guī)外泌體提取試劑廠家
研究中研究人員發(fā)現(xiàn),胃病細(xì)胞周?chē)缓琓AM。TAM以M2極化表型為特征,并促進(jìn)胃病細(xì)胞在體外和體內(nèi)的遷移。此外,研究人員發(fā)現(xiàn)M2衍生的外泌體決定了TAMs介導(dǎo)的遷移活動(dòng)。通過(guò)使用質(zhì)譜方法,研究人員確定載脂蛋白E(ApoE)是M2巨噬細(xì)胞衍生的外泌體中高度特異性和有效的蛋白質(zhì)。ApoE是一種M2特異性且高度豐富的來(lái)源于M2外泌體的蛋白質(zhì),是決定胃病細(xì)胞遷移潛力的主要驅(qū)動(dòng)因素。然而,來(lái)自ApoE-/-的小鼠M2巨噬細(xì)胞的外泌體在體外和體內(nèi)對(duì)胃病細(xì)胞的遷移沒(méi)有顯著影響。在機(jī)制上,M2巨噬細(xì)胞衍生的外泌體介導(dǎo)ApoE啟動(dòng)的PI3K-Akt信號(hào)通路,并在TAM和受體胃病細(xì)胞之間進(jìn)行細(xì)胞間轉(zhuǎn)移,促進(jìn)細(xì)胞骨架的遷移。總的來(lái)說(shuō),該研究發(fā)現(xiàn)外泌體介導(dǎo)的功能性ApoE蛋白從TAM轉(zhuǎn)移到一些病癥細(xì)胞,促進(jìn)了胃病細(xì)胞的遷移。長(zhǎng)沙正規(guī)外泌體提取試劑廠家
作為一種分子通斷開(kāi)關(guān)的KRAS發(fā)生突變時(shí)會(huì)處于“開(kāi)啟”狀態(tài)。在80%~95%的胰腺導(dǎo)管腺病(PDAC)當(dāng)中,這個(gè)基因發(fā)生突變,這也是這種一些疾病中較為常見(jiàn)的突變。這些研究人員證實(shí)iExosome能夠運(yùn)送特異性地靶向KRAS的siRNA和shRNA分子,并且比他們的合成對(duì)應(yīng)物脂質(zhì)體(liposome)更加高效。脂質(zhì)體不具有外泌體表現(xiàn)出的天然復(fù)雜性和優(yōu)勢(shì)。德州大學(xué)MD安德森一些疾病中心一些疾病生物學(xué)助理教授ValerieLeBleu博士說(shuō),“我們的研究提示著與脂質(zhì)體相比,外泌體表現(xiàn)出運(yùn)送siRNA分子和壓制侵襲性胰腺瘤生長(zhǎng)的優(yōu)異能力。我們也證實(shí)外泌體表面上的CD47存在允許它們躲避來(lái)自循環(huán)單核細(xì)胞...
- 徐州外泌體提取試劑單價(jià) 2025-07-15
- 武漢正規(guī)外泌體提取試劑廠家 2025-07-15
- 貴陽(yáng)外泌體提取試劑哪里買(mǎi) 2025-07-15
- 廣州正規(guī)外泌體提取試劑產(chǎn)品介紹 2025-07-15
- 南京外泌體提取試劑單價(jià) 2025-07-14
- 唐山外泌體提取試劑供應(yīng)商 2025-07-14
- 南昌正規(guī)外泌體提取試劑廠家 2025-07-14
- 寧波外泌體提取試劑廠家直銷(xiāo) 2025-07-14
- 武漢正規(guī)外泌體提取試劑哪里買(mǎi) 2025-07-14
- 南昌外泌體提取試劑供應(yīng)商 2025-07-14
- 北京外泌體提取試劑供應(yīng)商 2025-07-14
- 重慶正規(guī)外泌體提取試劑生產(chǎn)廠家 2025-07-14
- 長(zhǎng)沙外泌體提取試劑產(chǎn)品介紹 2025-07-14
- 貴陽(yáng)外泌體提取試劑產(chǎn)品介紹 2025-07-13
- 珠海外泌體提取試劑哪家便宜 2025-07-13
- 杭州外泌體提取試劑價(jià)格 2025-07-13


- 南昌正規(guī)細(xì)胞外基質(zhì)膠廠家推薦 07-15
- 武漢正規(guī)外泌體提取試劑廠家 07-15
- 開(kāi)封細(xì)胞外基質(zhì)膠價(jià)格 07-15
- 貴陽(yáng)外泌體提取試劑哪里買(mǎi) 07-15
- 唐山細(xì)胞外基質(zhì)膠單價(jià) 07-15
- 廣州正規(guī)外泌體提取試劑產(chǎn)品介紹 07-15
- 南京外泌體提取試劑單價(jià) 07-14
- 唐山外泌體提取試劑供應(yīng)商 07-14
- 南昌正規(guī)外泌體提取試劑廠家 07-14
- 石家莊正規(guī)細(xì)胞外基質(zhì)膠哪家便宜 07-14