- 產地
- 蘇州
- 品牌
- 外泌體提取試劑
- 型號
- 齊全
- 是否定制
- 是
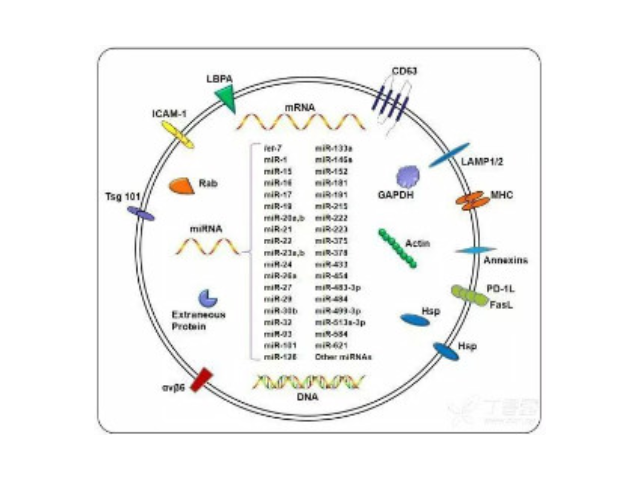
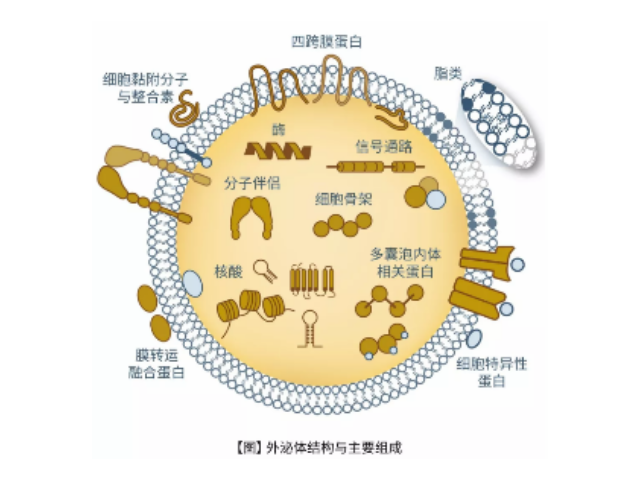
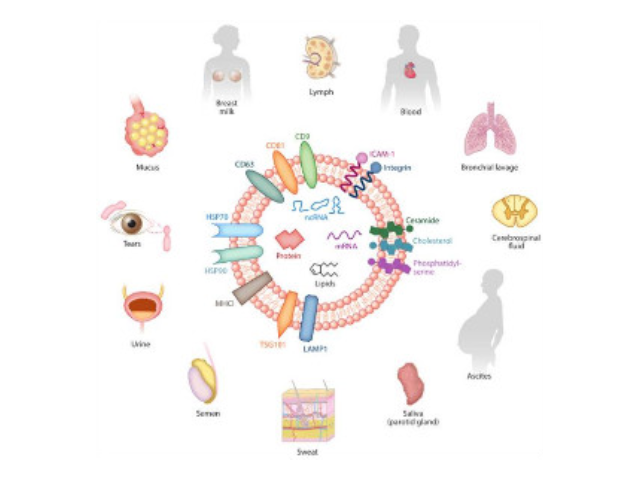
外泌體鑒定:參與生物功能的分子,如凋亡轉接基因2互作蛋白X(ALIX)、一些病癥易感基因101蛋白(TSG101)、熱休克蛋白(HSP70、HSP90),以及細胞分泌的特異性蛋白。外泌體高通量檢測。外泌體內含有與細胞來源相關的蛋白質和核酸,可以運輸蛋白質、mRNA、miRNA、lncRNA、circRNA等進入受體細胞,參與細胞間通訊。不同細胞來源的外泌體所含有的蛋白成分和RNA不太相同,可作為多種疾病的早期診斷標記物,也能作為靶向藥物的載體進行疾病治病。高通量測序。2.mRNA高通量測序。芯片(人、小鼠)。芯片(人、小鼠)。5.蛋白質組分析(iTRAQ、TMT、Label-free)。靜置10~15分鐘,留取沉淀物備用。濟南外泌體提取試劑廠家直銷

外泌體的提取方法:1.超速離心法(差速離心)。超離法是較常用的外泌體純化手段,采用低速離心、高速離心交替進行,可分離到大小相近的囊泡顆粒。超離法因操作簡單,獲得的囊泡數量較多而廣受歡迎,但過程比較費時,且回收率不穩定(可能與轉子類型有關),純度也受到質疑;此外,重復離心操作還有可能對囊泡造成損害,從而降低其質量。2.密度梯度離心。在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。通過密度梯度離心,樣品中的外泌體將在1.13-1.19g/ml的密度范圍富集。此法獲得的外泌體純度較高,但步驟繁瑣,耗時,對離心時間極為敏感深圳外泌體提取試劑單價外泌體提取:重復離心操作還有可能對囊泡造成損害,從而降低其質量。
外泌體的提取方法:1.超速離心法(差速離心)。超離法是較常用的外泌體純化手段,采用低速離心、高速離心交替進行,可分離到大小相近的囊泡顆粒。超離法因操作簡單,獲得的囊泡數量較多而廣受歡迎,但過程比較費時,且回收率不穩定(可能與轉子類型有關),純度也受到質疑;此外,重復離心操作還有可能對囊泡造成損害,從而降低其質量。2.密度梯度離心。在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。通過密度梯度離心,樣品中的外泌體將在1.13-1.19g/ml的密度范圍富集。此法獲得的外泌體純度較高,但步驟繁瑣,耗時,對離心時間極為敏感。
研究中研究人員發現,胃病細胞周圍富含TAM。TAM以M2極化表型為特征,并促進胃病細胞在體外和體內的遷移。此外,研究人員發現M2衍生的外泌體決定了TAMs介導的遷移活動。通過使用質譜方法,研究人員確定載脂蛋白E(ApoE)是M2巨噬細胞衍生的外泌體中高度特異性和有效的蛋白質。ApoE是一種M2特異性且高度豐富的來源于M2外泌體的蛋白質,是決定胃病細胞遷移潛力的主要驅動因素。然而,來自ApoE-/-的小鼠M2巨噬細胞的外泌體在體外和體內對胃病細胞的遷移沒有顯著影響。在機制上,M2巨噬細胞衍生的外泌體介導ApoE啟動的PI3K-Akt信號通路,并在TAM和受體胃病細胞之間進行細胞間轉移,促進細胞骨架的遷移。總的來說,該研究發現外泌體介導的功能性ApoE蛋白從TAM轉移到一些病癥細胞,促進了胃病細胞的遷移。外泌體提取:磁珠法具有特異性高、操作簡便、不影響外泌體形態完整等優點。
外泌體的提取的方式:1、免疫磁珠法,這種方法可以保證外泌體形態的完整,特異性高、操作簡單、不需要昂貴的儀器設備,但是非中性pH和非生理性鹽濃度會影響外泌體生物活性,不便進行下一步的實驗。2、PS親和法,該方法將PS(磷脂酰絲氨酸)與磁珠結合,利用親和原理捕獲外泌體囊泡外的PS。該方法與免疫磁珠法相似,獲得的外泌體形態完整,純度較高。由于不使用變性劑,不影響外泌體的生物活性,外泌體可用于細胞共培養和體內注射。2016.9《ScientificReports》雜志發表了該方法較新數據,表明PS法可提取相當高純度的外泌體。六是色譜法,這種方法分離到的外泌體在電鏡下大小均一,但是需要特殊的設備,應用不普遍。外泌體的分離純化一直是科研工作者關注的問題,獲得高純度的外泌體對后續的研究至關重要。溫州正規外泌體提取試劑價格
多聚物沉淀法早先應用于從血清等樣本中收集病毒,現在也被用來沉淀外泌體。濟南外泌體提取試劑廠家直銷
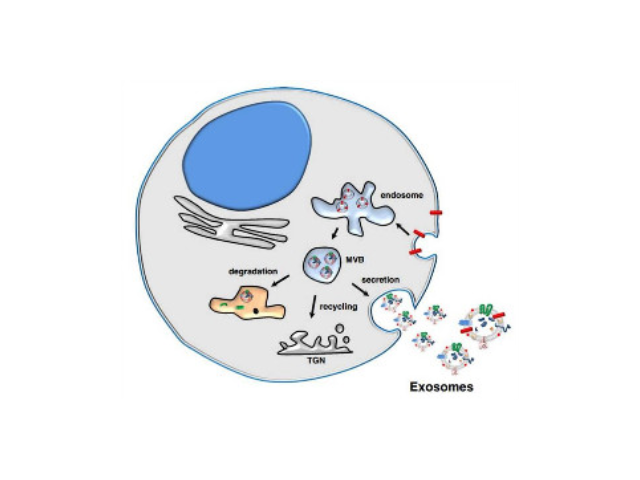
目前的主流觀點認為,外泌體的產生過程為:細胞膜內陷,形成內體(endosome),再形成多泡體(multivesicularbodies,MVB),較后分泌到胞外成為外泌體。外泌體中攜帶有母細胞的多種蛋白質、脂類、DNA和RNA等重要信息。外泌體較早見于1981年,EGTrams等在體外培養的綿羊紅細胞上清液中發現了有膜結構的小囊泡,并命名為exosome。對于外泌體的作用,當時推測為細胞排泄廢物的一種方式。1996年GRaposo等發現類似于B淋巴細胞的免疫細胞也會分泌抗原呈遞外泌體(antigenpresentingvesicle),所分泌的外泌體可以直接刺激效應CD4+細胞的抗一些病癥反應。2007年HValadi等進一步發現細胞之間可以通過外泌體中RNA交換遺傳物質。隨著有關外泌體研究越來越多,研究者發現它普遍參與了機體免疫應答、抗原呈遞、細胞分化、一些病癥生長于侵襲等各種生物過程中。目前人們多采用超速離心、免疫磁珠、超濾、沉淀或試劑盒等方法實現外泌體的提取分離。濟南外泌體提取試劑廠家直銷
作為一種分子通斷開關的KRAS發生突變時會處于“開啟”狀態。在80%~95%的胰腺導管腺病(PDAC)當中,這個基因發生突變,這也是這種一些疾病中較為常見的突變。這些研究人員證實iExosome能夠運送特異性地靶向KRAS的siRNA和shRNA分子,并且比他們的合成對應物脂質體(liposome)更加高效。脂質體不具有外泌體表現出的天然復雜性和優勢。德州大學MD安德森一些疾病中心一些疾病生物學助理教授ValerieLeBleu博士說,“我們的研究提示著與脂質體相比,外泌體表現出運送siRNA分子和壓制侵襲性胰腺瘤生長的優異能力。我們也證實外泌體表面上的CD47存在允許它們躲避來自循環單核細胞...
- 徐州外泌體提取試劑單價 2025-07-15
- 武漢正規外泌體提取試劑廠家 2025-07-15
- 貴陽外泌體提取試劑哪里買 2025-07-15
- 廣州正規外泌體提取試劑產品介紹 2025-07-15
- 南京外泌體提取試劑單價 2025-07-14
- 唐山外泌體提取試劑供應商 2025-07-14
- 南昌正規外泌體提取試劑廠家 2025-07-14
- 寧波外泌體提取試劑廠家直銷 2025-07-14
- 武漢正規外泌體提取試劑哪里買 2025-07-14
- 南昌外泌體提取試劑供應商 2025-07-14
- 北京外泌體提取試劑供應商 2025-07-14
- 重慶正規外泌體提取試劑生產廠家 2025-07-14
- 長沙外泌體提取試劑產品介紹 2025-07-14
- 貴陽外泌體提取試劑產品介紹 2025-07-13
- 珠海外泌體提取試劑哪家便宜 2025-07-13
- 杭州外泌體提取試劑價格 2025-07-13


- 南昌正規細胞外基質膠廠家推薦 07-15
- 武漢正規外泌體提取試劑廠家 07-15
- 開封細胞外基質膠價格 07-15
- 貴陽外泌體提取試劑哪里買 07-15
- 唐山細胞外基質膠單價 07-15
- 廣州正規外泌體提取試劑產品介紹 07-15
- 南京外泌體提取試劑單價 07-14
- 唐山外泌體提取試劑供應商 07-14
- 南昌正規外泌體提取試劑廠家 07-14
- 石家莊正規細胞外基質膠哪家便宜 07-14