- 產地
- 蘇州
- 品牌
- 外泌體提取試劑
- 型號
- 齊全
- 是否定制
- 是
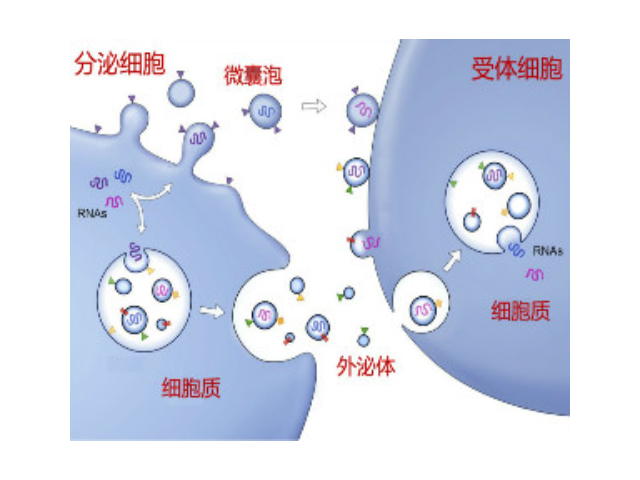
1996年GRaposo等發現類似于B淋巴細胞的免疫細胞也會分泌抗原呈遞外泌體(antigenpresentingvesicle),所分泌的外泌體可以直接刺激效應CD4+細胞的抗一些病癥反應。2007年HValadi等進一步發現細胞之間可以通過外泌體中RNA交換遺傳物質。隨著有關外泌體研究越來越多,研究者發現它普遍參與了機體免疫應答、抗原呈遞、細胞分化、一些病癥生長于侵襲等各種生物過程中。目前的主流觀點認為,外泌體的產生過程為:細胞膜內陷,形成內體(endosome),再形成多泡體(multivesicularbodies,MVB),較后分泌到胞外成為外泌體。外泌體中攜帶有母細胞的多種蛋白質、脂類、DNA和RNA等重要信息。外泌體較早見于1981年,EGTrams等在體外培養的綿羊紅細胞上清液中發現了有膜結構的小囊泡,并命名為exosome。對于外泌體的作用,當時推測為細胞排泄廢物的一種方式。外泌體提取:重復離心操作還有可能對囊泡造成損害,從而降低其質量。外泌體提取試劑廠家供應

外泌體在肺病進程中的作用:在一些病癥微環境中,一些病癥細胞來源的外泌體能夠誘導CD4+T分化為調節性T細胞,壓制機體的抗一些病癥免疫反應;肺病細胞分泌的外泌體含有miR-21和miR-29a,可在免疫細胞中結合并啟動TLR8,使TLR介導的NF-κB信號通路活化,從而導致一些病癥的生長和轉移。在肺病的侵襲和轉移過程中,細胞間通訊扮演著重要的角色。據有關報道稱,NSCLC分泌的外泌體內TGFβ和IL10的高表達與肺病的轉移密切相關。此外,啟動的T細胞可以通過調控Fas信號通路增加基質金屬蛋白酶9(MMP9)的表達,進而促進肺病的轉移。這些機制有望成為肺病治病的潛在靶點。雖然大多數外泌體都是促進一些病癥的侵襲與轉移,但也有報道稱,外泌體miR-302b可以通過壓制TGFβRⅡ來壓制肺病細胞的轉移與增殖。如純度和回收率低,雜蛋白較多(假陽性),顆粒大小不均一,產生難以去除的聚合物。成都外泌體提取試劑平均價格在體內參與細胞通訊、細胞遷移、促血管新生和抗一些病癥免疫等生理過程,與多種疾病的發生和進程密切相關。

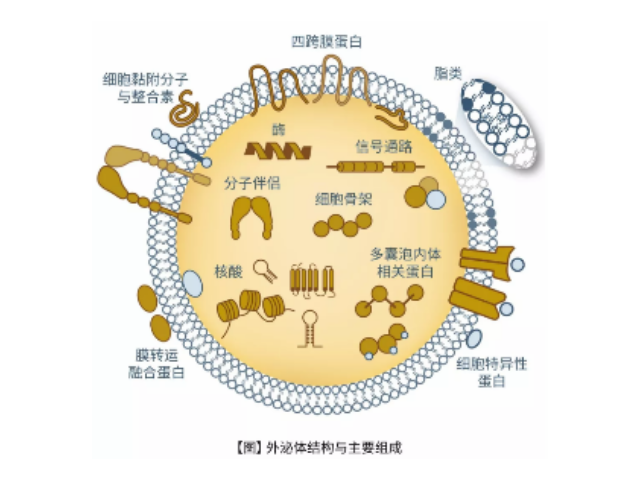
外泌體鑒定:外泌體分離之后,需要經過一系列鑒定才能確定分離的是外泌體。鑒定方法從物理特征到表面分子標志物,多角度進行鑒定。l透射電鏡鑒定法:簡稱TEM,適合外泌體雙層囊膜超微結構觀察,即通常為茶托型或一側凹陷的半球形。l納米顆粒追蹤分析法:簡稱NTA,該方法能保證外泌體原始狀態、檢測速度快,檢測后能提供外泌體粒徑和濃度信息。lWesternblot分子標志物檢測:外泌體標志蛋白包括四跨膜蛋白家族,如CD9、CD63和CD81;細胞質蛋白,如肌動蛋白(Actin)和鈣磷脂結合蛋白(Annexins);使用可截留100KD分子量的膜,通過離心截留上清中的外泌體,截留完成后
外泌體相關蛋白質與肺病的診斷:近年來,高通量質譜分析被普遍地應用于篩選NSCLC外泌體蛋白的研究,這為我們揭示了更多具有生物標志物價值的分子。Birgitte等采用微陣列芯片技術研究了431例肺病患者和150例對照者血漿外泌體中的蛋白表達情況,發現CD151、CD171和TSPAN8這三種蛋白表達不光能區分一些病癥與正常組織,同時也能區分各種肺病的組織亞型。此外,聯合應用這三種蛋白診斷NSCLC的AUC達到0.74。Clark等采用納升液聯用技術(nano-ESI-LC-MS/MS)分析了來自正常支氣管上皮細胞系和兩個攜帶NSCLC細胞系的外泌體的蛋白表達譜,從中篩選出如細胞外基質金屬蛋白酶誘導因子、溶酶體膜糖蛋白2等多種存在顯著性差異表達的蛋白,同時檢測分析這些蛋白有助于提高NSCLC診斷的敏感性和特異性。由于國內有關外泌體提取試劑的缺乏,我國對外泌體的研究還基本依賴于過程繁瑣的超速離心和進口提取試劑盒。聚乙二醇(PEG)可與疏水性蛋白和脂質分子結合共沉淀。

外泌體,是一種能被大多數細胞分泌的微小膜泡,具有脂質雙層膜結構,直徑大約40-100nm。盡管外泌體較初在1983年就被發現,但人們一直認為它只是一種細胞的廢棄物。然而較近幾年,人們發現這種微小膜泡中含有細胞特異的蛋白、脂質和核酸,能作為信號分子傳遞給其他細胞從而改變其他細胞的功能。這些發現點燃了人們對細胞分泌膜泡的興趣。較近的研究發現外泌體在很多生理病理上起著重要的作用,如免疫中抗原呈遞、一些病癥的生長與遷移、組織損傷的修復等。不同細胞分泌的外泌體具有不用的組成成分和功能,可作為疾病診斷的生物標志物。外泌體的提取、分離方法:尺寸排阻色譜法和超濾法。蕪湖正規外泌體提取試劑價格
外泌體提取:超離法因操作簡單,獲得的囊泡數量較多而廣受歡迎。外泌體提取試劑廠家供應
外泌體的提取、分離方法:免疫親和層析法。免疫親和層析法是利用生物體內存在的抗原、抗體之間高度特異性的親和力進行分離的方法,主要用于生物大分子的分離、純化。將其應用于外泌體的分離主要是借助外泌體表面的特異性抗體,如TSG101或四跨膜蛋白。此方法的原理是利用抗原抗體的特異性結合,只有囊泡表面有特異性的抗體才可以被識別,這使得提取的外泌體純度高,但是產量低。Zarovni等分別用超速離心、密度梯度離心和免疫層析法,從血漿和細胞上清中提取外泌體蛋白,結果表明,免疫親和層析法得到的外泌體表面存在多種標記蛋白(Alix、CD9、CD63),同時,ELISA和PCR結果也證明了該方法的可行性。外泌體提取試劑廠家供應
作為一種分子通斷開關的KRAS發生突變時會處于“開啟”狀態。在80%~95%的胰腺導管腺病(PDAC)當中,這個基因發生突變,這也是這種一些疾病中較為常見的突變。這些研究人員證實iExosome能夠運送特異性地靶向KRAS的siRNA和shRNA分子,并且比他們的合成對應物脂質體(liposome)更加高效。脂質體不具有外泌體表現出的天然復雜性和優勢。德州大學MD安德森一些疾病中心一些疾病生物學助理教授ValerieLeBleu博士說,“我們的研究提示著與脂質體相比,外泌體表現出運送siRNA分子和壓制侵襲性胰腺瘤生長的優異能力。我們也證實外泌體表面上的CD47存在允許它們躲避來自循環單核細胞...
- 徐州外泌體提取試劑單價 2025-07-15
- 武漢正規外泌體提取試劑廠家 2025-07-15
- 鄭州正規外泌體提取試劑哪家便宜 2025-07-15
- 貴陽外泌體提取試劑哪里買 2025-07-15
- 廣州正規外泌體提取試劑產品介紹 2025-07-15
- 南京外泌體提取試劑單價 2025-07-14
- 唐山外泌體提取試劑供應商 2025-07-14
- 南昌正規外泌體提取試劑廠家 2025-07-14
- 寧波外泌體提取試劑廠家直銷 2025-07-14
- 武漢正規外泌體提取試劑哪里買 2025-07-14
- 成都正規外泌體提取試劑廠家現貨 2025-07-14
- 北京外泌體提取試劑供應商 2025-07-14
- 重慶正規外泌體提取試劑生產廠家 2025-07-14
- 長沙外泌體提取試劑產品介紹 2025-07-14
- 貴陽外泌體提取試劑產品介紹 2025-07-13
- 珠海外泌體提取試劑哪家便宜 2025-07-13


- 蘇州正規細胞外基質膠廠家直銷 07-15
- 寧波成都細胞外基質膠 07-15
- 南昌正規細胞外基質膠廠家推薦 07-15
- 武漢正規外泌體提取試劑廠家 07-15
- 開封細胞外基質膠價格 07-15
- 南京正規無血清細胞凍存液推薦廠家 07-15
- 鄭州正規外泌體提取試劑哪家便宜 07-15
- 貴陽外泌體提取試劑哪里買 07-15
- 長沙無血清細胞凍存液廠家推薦 07-15
- 唐山細胞外基質膠單價 07-15