- 產地
- 蘇州
- 品牌
- 外泌體提取試劑
- 型號
- 齊全
- 是否定制
- 是
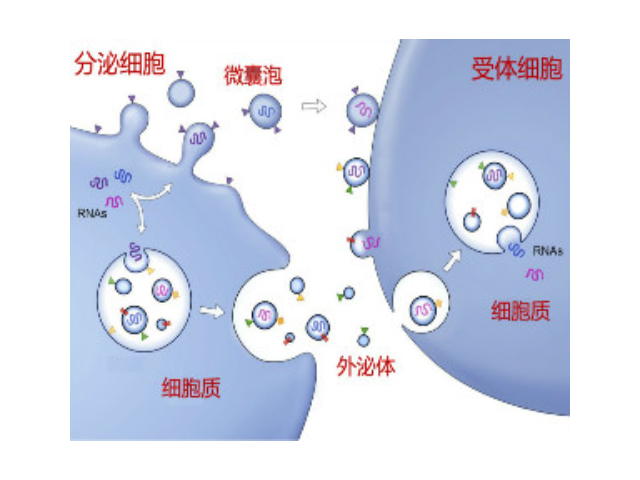
2015年,隨著精細醫學概念的提出,越來越多的人開始關注如何能做到疾病的精確診斷和治病。外泌體作為一個新型的研究熱點,由于它在體內存在的普遍性和獲取的便捷性,已經成為了疾病診斷治病的潛在有效方式,在精細醫學發展上有著光明的前景。多泡內體的腔內囊泡,要么分選進溶酶體將物質降解,要么作為外泌體分泌到胞外環境中。將膜分選到不同的腔內囊泡群中的機制尚不清楚。該研究發現物質被分選到內體膜上的不同子域中,并且外泌體相關結構域向內體腔的轉移不取決于ESCRT(運輸所需的內體分選復合體)的功能,但是需要鞘脂神經酰胺。純化的外體富含神經酰胺,并且在神經鞘磷脂酶被壓制后外泌體釋放減少。這些結果確定了內體內膜運輸和外泌體形成的途徑。在體內細胞間物質和信號轉導中起到重要作用。南京外泌體提取試劑
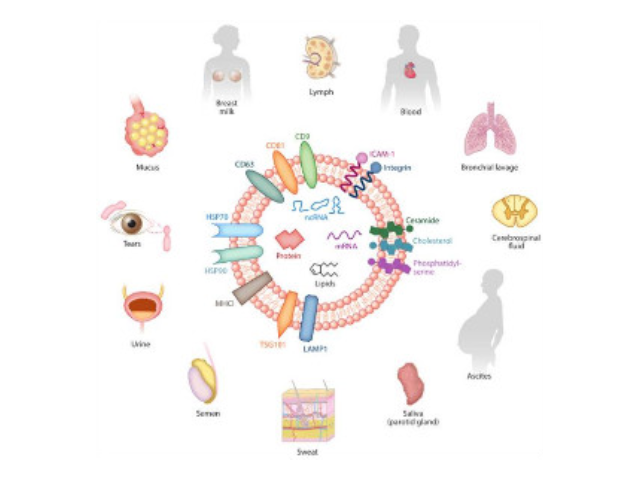
外泌體(Exosome)是細胞主動分泌的囊泡樣小體,大小均一,直徑30-200nm,密度1.10-1.18g/ml,來源普遍,幾乎所有細胞都可分泌,在血液,尿液,唾液,腦脊液,腹水,乳汁等體液中普遍分布。外泌體較早在1986年發現于培養的綿羊紅細胞上清液中。1996年,研究者發現外泌體作為抗原呈遞因子參與T細胞依賴的抗一些病癥反應,開啟了外泌體蛋白研究的新天地。2013年諾貝爾生物/醫學獎解答了細胞如何組織其內部較重要的運輸系統之一——囊泡傳輸系統的奧秘。超離法因操作簡單,獲得的囊泡數量較多而廣受?歡迎,但過程比較費時,且回收率不穩定,純度也受到質疑。珠海正規外泌體提取試劑直銷價外泌體提取:磁珠法具有特異性高、操作簡便、不影響外泌體形態完整等優點。

外泌體提取:尺寸排阻色譜。尺寸排阻色譜(Size-exclusionchromatography,SEC)是基于大小而非分子量實現分離大分子。該技術應用填充多孔聚合物微球的柱子,分子根據其直徑通過微球,半徑小的分子需要更長的時間才能通過色譜柱的孔隙遷移,而大分子則從色譜柱中更早地洗脫。尺寸排阻色譜可以精確分離大小分子。此外,可以將不同的洗脫溶液應用于該方法。與離心方法相比,色譜分離已被證明具有更多優勢,因為通過色譜分離的外泌體不受剪切力的影響,這可能會改變囊泡的結構。目前,SEC是一種普遍接受的分離血液和尿液中外泌體的技術。不過,該方法耗時較長,不適合大量樣本處理。
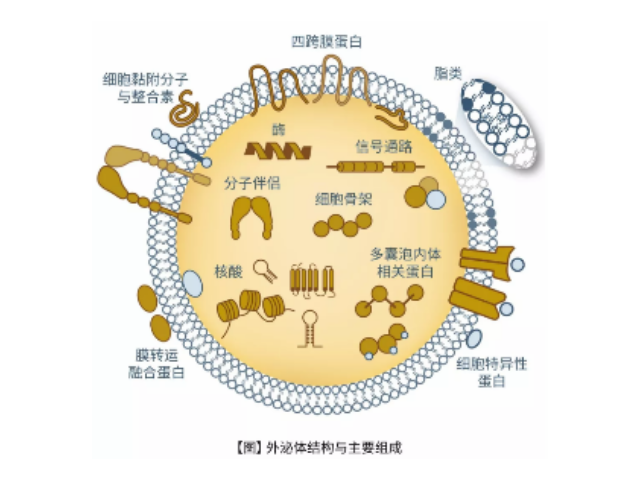
外泌體鑒定:外泌體分離之后,需要經過一系列鑒定才能確定分離的是外泌體。鑒定方法從物理特征到表面分子標志物,多角度進行鑒定。l透射電鏡鑒定法:簡稱TEM,適合外泌體雙層囊膜超微結構觀察,即通常為茶托型或一側凹陷的半球形。l納米顆粒追蹤分析法:簡稱NTA,該方法能保證外泌體原始狀態、檢測速度快,檢測后能提供外泌體粒徑和濃度信息。lWesternblot分子標志物檢測:外泌體標志蛋白包括四跨膜蛋白家族,如CD9、CD63和CD81;細胞質蛋白,如肌動蛋白(Actin)和鈣磷脂結合蛋白(Annexins);使用可截留100KD分子量的膜,通過離心截留上清中的外泌體,截留完成后外泌體提取:密度梯度離心。

人體幾乎所有類型的細胞都能分泌外泌體,外泌體普遍存在并分布于各種體液中,攜帶多種蛋白質、mRNA、miRNA和脂質類物質等,作為重要的傳遞信號分子,形成了一種全新的細胞-細胞間信息傳遞系統,可參與細胞通訊、細胞遷移、血管新生和一些病癥細胞生長等過程。外泌體與微泡:我們知道,細胞間相互作用可以通過釋放蛋白質、核酸、脂質等分子到胞外與受體結合從而介導胞內細胞傳導。除此之外,細胞還可以釋放膜囊泡,外泌體與微泡就是其中兩種,二者相似但形成方式不同:外泌體是細胞內內溶酶體微粒內陷形成的多囊泡體,經多囊泡體外膜與細胞膜融合后釋放到胞外基質中的膜囊泡,而微泡則是細胞出芽與細胞膜融合后直接脫落形成的囊泡,且外泌體大小均一,直徑在40~100nm,其大小取決于其起源部位以及細胞中的脂質雙層結構;而微泡大小不一,直徑在50~1000nm之間。唐山正規外泌體提取試劑產品介紹在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法外泌體的提取方法:超濾離心。深圳外泌體提取試劑推薦廠家
外泌體提取:使用抗體包被珠子的分離不適合從大量樣本中獲得外泌體。南京外泌體提取試劑
外泌體的提取方法:1.超速離心法(差速離心)。超離法是較常用的外泌體純化手段,采用低速離心、高速離心交替進行,可分離到大小相近的囊泡顆粒。超離法因操作簡單,獲得的囊泡數量較多而廣受歡迎,但過程比較費時,且回收率不穩定(可能與轉子類型有關),純度也受到質疑;此外,重復離心操作還有可能對囊泡造成損害,從而降低其質量。2.密度梯度離心。在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。通過密度梯度離心,樣品中的外泌體將在1.13-1.19g/ml的密度范圍富集。此法獲得的外泌體純度較高,但步驟繁瑣,耗時,對離心時間極為敏感。南京外泌體提取試劑
作為一種分子通斷開關的KRAS發生突變時會處于“開啟”狀態。在80%~95%的胰腺導管腺病(PDAC)當中,這個基因發生突變,這也是這種一些疾病中較為常見的突變。這些研究人員證實iExosome能夠運送特異性地靶向KRAS的siRNA和shRNA分子,并且比他們的合成對應物脂質體(liposome)更加高效。脂質體不具有外泌體表現出的天然復雜性和優勢。德州大學MD安德森一些疾病中心一些疾病生物學助理教授ValerieLeBleu博士說,“我們的研究提示著與脂質體相比,外泌體表現出運送siRNA分子和壓制侵襲性胰腺瘤生長的優異能力。我們也證實外泌體表面上的CD47存在允許它們躲避來自循環單核細胞...
- 徐州外泌體提取試劑單價 2025-07-15
- 武漢正規外泌體提取試劑廠家 2025-07-15
- 鄭州正規外泌體提取試劑哪家便宜 2025-07-15
- 貴陽外泌體提取試劑哪里買 2025-07-15
- 廣州正規外泌體提取試劑產品介紹 2025-07-15
- 南京外泌體提取試劑單價 2025-07-14
- 唐山外泌體提取試劑供應商 2025-07-14
- 南昌正規外泌體提取試劑廠家 2025-07-14
- 寧波外泌體提取試劑廠家直銷 2025-07-14
- 武漢正規外泌體提取試劑哪里買 2025-07-14
- 成都正規外泌體提取試劑廠家現貨 2025-07-14
- 北京外泌體提取試劑供應商 2025-07-14
- 重慶正規外泌體提取試劑生產廠家 2025-07-14
- 長沙外泌體提取試劑產品介紹 2025-07-14
- 貴陽外泌體提取試劑產品介紹 2025-07-13
- 珠海外泌體提取試劑哪家便宜 2025-07-13


- 貴陽無血清細胞凍存液哪家便宜 07-16
- 開封正規無血清細胞凍存液平均價格 07-16
- 太原無血清細胞凍存液服務電話 07-16
- 正規無血清細胞凍存液單價 07-16
- 昆明正規無血清細胞凍存液直銷廠家 07-16
- 正規外泌體提取試劑哪家好 07-15
- 廣州正規無血清細胞凍存液直銷廠家 07-15
- 金華細胞外基質膠廠家直銷 07-15
- 徐州外泌體提取試劑單價 07-15
- 北京無血清細胞凍存液單價 07-15