- 產地
- 蘇州
- 品牌
- 外泌體提取試劑
- 型號
- 齊全
- 是否定制
- 是
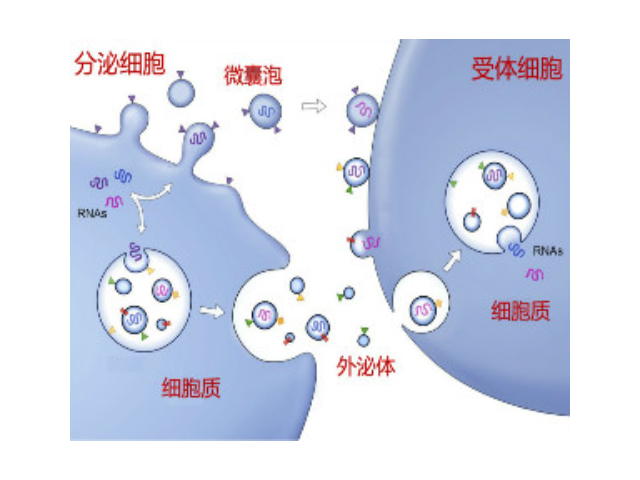
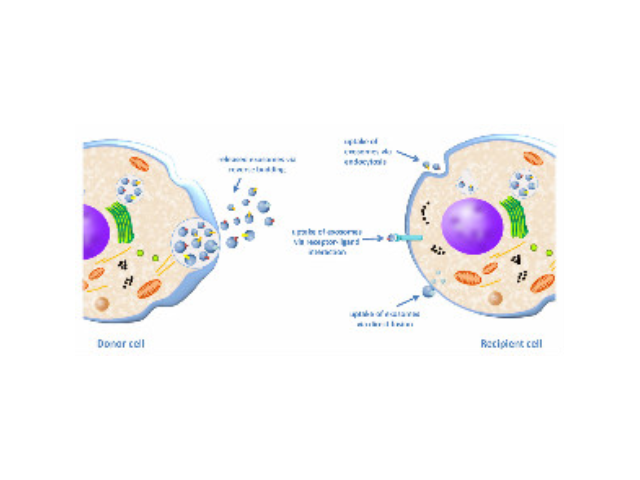
外泌體是細胞間進行物質運輸和信息交流的重要工具,可以通過調節免疫功能促進一些病癥的增殖,血管新生和一些病癥轉移。與細菌傳染,幫助細菌逃避免疫關系很大,并與心血管疾病,老年癡呆等疾病具有密切關系。外泌體可通過流式、WB(檢測指標有CD9,CD63,CD81)、電鏡觀察、NTA粒徑追蹤等手段檢測,普遍應用于藥物載體、疾病診斷marker、精細醫療、一些病癥治病等方面研究。由于外泌體直徑小,樣本含量低,提取十分困難。已有的外泌體分離方式有密度梯度離心、超濾離心法、免疫磁珠抗體捕獲、商用試劑盒等。但到目前為止,仍沒有一種提取方法能同時保證外泌體的含量、純度以及生物活性。如何高效地提取外泌體是實現這項新興液體活檢技術臨床常規化應用的關鍵。徐州正規外泌體提取試劑銷售廠家
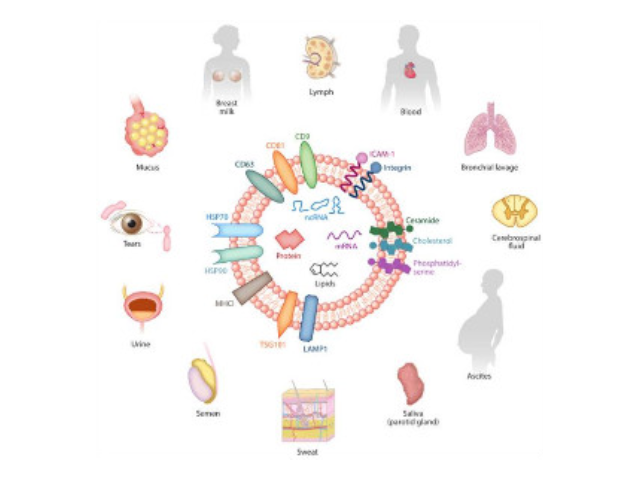
外泌體的提取方法:1、磁珠免疫法。外泌體表面有其特異性標記物(如CD63、CD9蛋白),用包被抗標記物抗體的磁珠與外泌體囊泡孵育后結合,即可將外泌體吸附并分離出來。磁珠法具有特異性高、操作簡便、不影響外泌體形態完整等優點,但是效率低,外泌體生物活性易受pH和鹽濃度影響,不利于下游實驗,難以普遍普及。2、多聚物沉淀法。聚乙二醇(PEG)為常用的多聚物,可與疏水性蛋白和脂質分子結合共沉淀,早先應用于從血清等樣本中收集病毒,現在也被用來沉淀外泌體,其原理可能與競爭性結合游離水分子有關。利用PEG沉淀外泌體存在不少問題:比如純度和回收率低,雜蛋白較多(假陽性),顆粒大小不均一,產生難以去除的聚合物,機械力或者吐溫-20等化學添加物將會破壞外泌體等外泌體提取試劑單價外泌體提取:差速離心。差速離心仍然是較常見的外泌體分離技術之一。
外泌體的提取主要包括以下幾種方式。一是超速離心法,這是目前外泌體提取較常用的方法。此種方法得到的外泌體量多,但是純度不足,電鏡鑒定時發現外泌體聚集成塊,由于微泡和外泌體沒有非常統一的鑒定標準,也有一些研究認為此種方法得到的是微泡不是外泌體。二是過濾離心,這種操作簡單、省時,不影響外泌體的生物活性,但同樣存在純度不足的問題。三是密度梯度離心法,用此種方法分離到的外泌體純度高,但是前期準備工作繁雜,耗時,量少。、
外泌體相關miRNA與肺病的診斷:miRNAs是一類含有20~25個核苷酸的非編碼小RNA,能夠通過下調或壓制靶mRNAs來調節轉錄水平上的基因表達,目前非編碼RNA被普遍發現存在于NSCLC患者外泌體中,參與一些病癥的形成和演化過程。單個miRNA可能通過壓制性復合物與多個mRNA結合,從而阻滯整個生物通路。因此,外泌體的miRNA具有成為NSCLC標志物的優勢。Chen等在152例肺病患者的研究中初次報道了循環游離miRNA的表達,與75例健康者相比,發現了兩種高表達的miRNA(miR-25和miR-223)。Rabinonowits等對27例肺病患者和9例健康人的血漿外泌體中12個miRNA的表達進行了評估,結果顯示,12個一些病癥相關的miRNA*在肺病患者中過度表達。Cazzoli等收集了30個血漿樣本,發現4種外泌體miRNA(miR-378a、-379a、-139-5p、-200b-5p)在肺病患者血清中明顯升高,用于篩查患者與健康人ROC曲線下面積(AUC)為0.908。由于外泌體的特殊結構和功能,使得它具有潛在的應用價值。
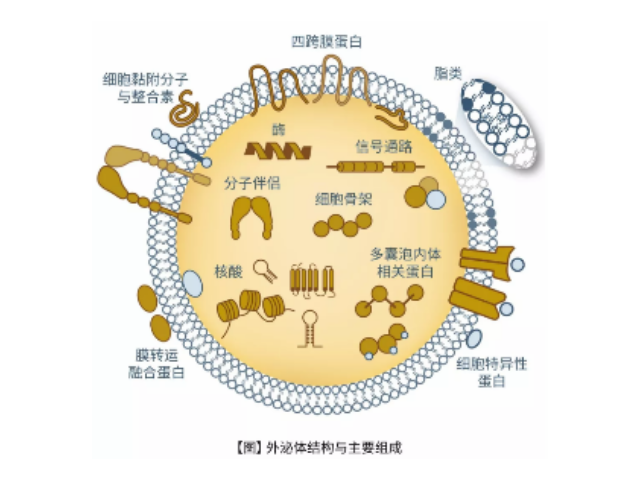
外泌體(Exosome)是細胞主動分泌的囊泡樣小體,大小均一,直徑30-200nm,密度1.10-1.18g/ml,來源普遍,幾乎所有細胞都可分泌,在血液,尿液,唾液,腦脊液,腹水,乳汁等體液中普遍分布。外泌體較早在1986年發現于培養的綿羊紅細胞上清液中。1996年,研究者發現外泌體作為抗原呈遞因子參與T細胞依賴的抗一些病癥反應,開啟了外泌體蛋白研究的新天地。2013年諾貝爾生物/醫學獎解答了細胞如何組織其內部較重要的運輸系統之一——囊泡傳輸系統的奧秘。外泌體提純試劑盒的特色與優勢:無需蛋白酶處理。天津外泌體提取試劑哪里買
外泌體的提取方法:磁珠免疫法。徐州正規外泌體提取試劑銷售廠家
外泌體提純試劑盒的特色與優勢:純化和富集的完整血漿/血清,尿液和細胞培養基中外泌體的可用于功能研究;樣本輸入量多樣;無需耗時的超速離心,過濾或特殊注射器;無需沉淀試劑,也無需過夜培養;無需蛋白酶處理;適用于多種物種;外泌體被純化并且不含任何其他RNA結合蛋白;可以使用NanoSight®或電子顯微鏡分析純化的外泌體,以評估近似外泌體大小范圍和濃度。外泌體(exosomes)是一種能被機體內大多數細胞分泌的直徑大約為30~150nm的具有脂質雙層膜的微小膜泡。它普遍存在并分布于各種體液中,攜帶和傳遞重要的信號分子,形成了一種全新的細胞間信息傳遞系統,影響細胞的生理狀態并與多種疾病的發生與進程密切相關徐州正規外泌體提取試劑銷售廠家
作為一種分子通斷開關的KRAS發生突變時會處于“開啟”狀態。在80%~95%的胰腺導管腺病(PDAC)當中,這個基因發生突變,這也是這種一些疾病中較為常見的突變。這些研究人員證實iExosome能夠運送特異性地靶向KRAS的siRNA和shRNA分子,并且比他們的合成對應物脂質體(liposome)更加高效。脂質體不具有外泌體表現出的天然復雜性和優勢。德州大學MD安德森一些疾病中心一些疾病生物學助理教授ValerieLeBleu博士說,“我們的研究提示著與脂質體相比,外泌體表現出運送siRNA分子和壓制侵襲性胰腺瘤生長的優異能力。我們也證實外泌體表面上的CD47存在允許它們躲避來自循環單核細胞...
- 徐州外泌體提取試劑單價 2025-07-15
- 武漢正規外泌體提取試劑廠家 2025-07-15
- 鄭州正規外泌體提取試劑哪家便宜 2025-07-15
- 貴陽外泌體提取試劑哪里買 2025-07-15
- 廣州正規外泌體提取試劑產品介紹 2025-07-15
- 南京外泌體提取試劑單價 2025-07-14
- 唐山外泌體提取試劑供應商 2025-07-14
- 南昌正規外泌體提取試劑廠家 2025-07-14
- 寧波外泌體提取試劑廠家直銷 2025-07-14
- 武漢正規外泌體提取試劑哪里買 2025-07-14
- 成都正規外泌體提取試劑廠家現貨 2025-07-14
- 北京外泌體提取試劑供應商 2025-07-14
- 重慶正規外泌體提取試劑生產廠家 2025-07-14
- 長沙外泌體提取試劑產品介紹 2025-07-14
- 貴陽外泌體提取試劑產品介紹 2025-07-13
- 珠海外泌體提取試劑哪家便宜 2025-07-13


- 貴陽無血清細胞凍存液哪家便宜 07-16
- 開封正規無血清細胞凍存液平均價格 07-16
- 太原無血清細胞凍存液服務電話 07-16
- 正規無血清細胞凍存液單價 07-16
- 昆明正規無血清細胞凍存液直銷廠家 07-16
- 正規外泌體提取試劑哪家好 07-15
- 廣州正規無血清細胞凍存液直銷廠家 07-15
- 金華細胞外基質膠廠家直銷 07-15
- 徐州外泌體提取試劑單價 07-15
- 北京無血清細胞凍存液單價 07-15