北京外泌體提取試劑廠家推薦
- 產(chǎn)地
- 蘇州
- 品牌
- 外泌體提取試劑
- 型號(hào)
- 齊全
- 是否定制
- 是
作為一種分子通斷開關(guān)的KRAS發(fā)生突變時(shí)會(huì)處于“開啟”狀態(tài)。在80%~95%的胰腺導(dǎo)管腺病(PDAC)當(dāng)中,這個(gè)基因發(fā)生突變,這也是這種一些疾病中較為常見的突變。這些研究人員證實(shí)iExosome能夠運(yùn)送特異性地靶向KRAS的siRNA和shRNA分子,并且比他們的合成對(duì)應(yīng)物脂質(zhì)體(liposome)更加高效。脂質(zhì)體不具有外泌體表現(xiàn)出的天然復(fù)雜性和優(yōu)勢(shì)。德州大學(xué)MD安德森一些疾病中心一些疾病生物學(xué)助理教授ValerieLeBleu博士說,“我們的研究提示著與脂質(zhì)體相比,外泌體表現(xiàn)出運(yùn)送siRNA分子和壓制侵襲性胰腺瘤生長的優(yōu)異能力。我們也證實(shí)外泌體表面上的CD47存在允許它們躲避來自循環(huán)單核細(xì)胞的吞噬作用。”外泌體提取:低速離心去除細(xì)胞和凋亡碎片。北京外泌體提取試劑廠家推薦
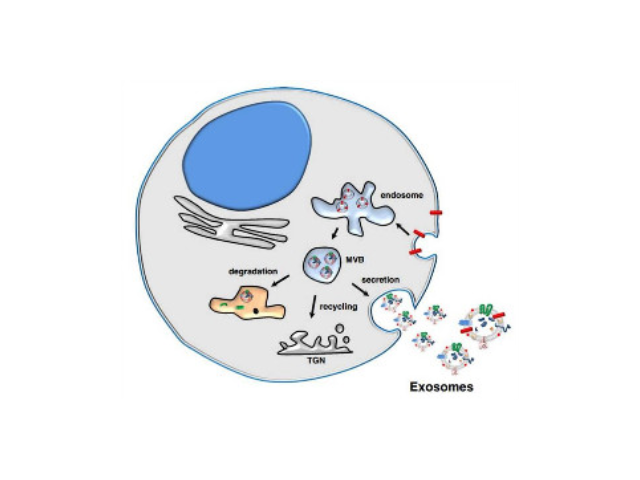
外泌體的生物學(xué)功能研究中需要分離完整的外泌體顆粒,而傳統(tǒng)超速離心方法步驟繁瑣、硬件要求高、操作難度大。李記生物自主開發(fā)的外泌體快速提取試劑盒,組分經(jīng)過優(yōu)化處理,適用于細(xì)胞培養(yǎng)上清液、血清、血漿、尿液及其他體液(腦脊液、腹水、羊水、乳汁以及唾液等)中的外泌體提取,并搭配純化過濾裝置,可快速高效地獲得高純度外泌體顆粒。注意事項(xiàng):1.對(duì)于待測(cè)樣品粘度過大時(shí),可將樣本用4℃預(yù)冷的1×PBS緩沖液進(jìn)行等體積稀釋處理。2.當(dāng)血清、血漿、唾液等樣品收獲的外泌體濃度較高,收獲的外泌體顆粒無法通過EPF柱純化時(shí),可用4℃預(yù)冷的1×PBS進(jìn)行稀釋后再通過EPF柱離心。3.針對(duì)外泌體標(biāo)志蛋白(CD63,CD9,CD81等)進(jìn)行Westernblot檢測(cè),可以鑒定所提的外泌體。通過超速離心(120000g/分鐘)20小時(shí)以上才能獲得足夠的外泌體量開封外泌體提取試劑哪家便宜超速離心法是目前外泌體相關(guān)文章中的主流方法,由于離心步驟繁瑣。
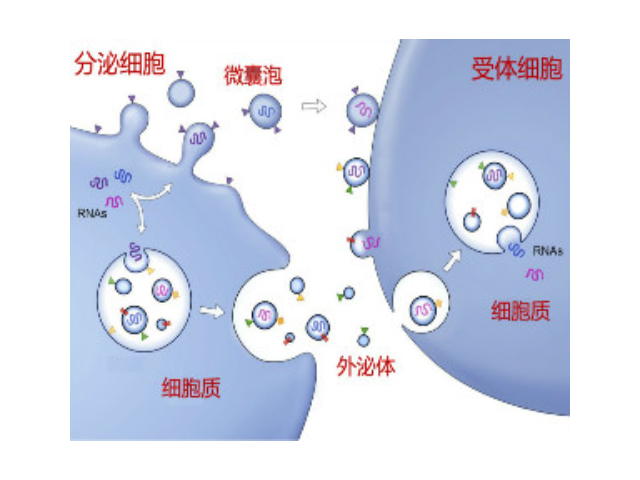
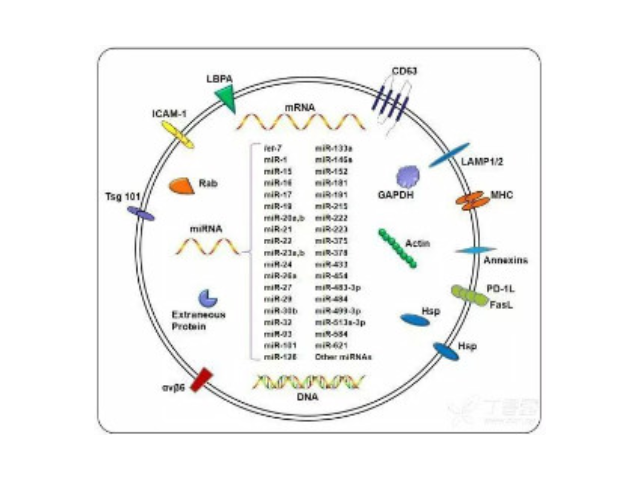
外泌體(Exosome)是由細(xì)胞分泌而來的微小囊泡,直徑約為30-200nm,密度在1.13-1.21g/ml,具有杯狀形態(tài)、雙層膜結(jié)構(gòu),天然存在于血液、尿液、唾液、母乳和細(xì)胞培養(yǎng)基等生物體液中。包括瘤細(xì)胞在內(nèi)幾乎所有類型的細(xì)胞(免疫細(xì)胞、神經(jīng)細(xì)胞、干細(xì)胞),都可以產(chǎn)生并釋放exosome。Exosome內(nèi)含有與細(xì)胞來源相關(guān)的蛋白質(zhì)rRNA和microRNA,Exosome可通過細(xì)胞膜受體直接受體細(xì)胞,也可運(yùn)輸?shù)鞍踪|(zhì)、mRNA、miRNA、lncRNA、circRNA,甚至細(xì)胞器進(jìn)入受體細(xì)胞,參與細(xì)胞間通訊。Exosome在免疫應(yīng)答、炎癥反應(yīng)、血管生成、凋亡、凝血和廢物處理等生理過程發(fā)揮關(guān)鍵作用,不同細(xì)胞來源的exosome所含有的RNA和蛋白成分不盡相同,可作為多種疾病的早期診斷標(biāo)記物,也能作為靶向藥物的載體進(jìn)行疾病
密度梯度離心法該方法由于比較繁瑣,用的較少。原理是:像所有的脂質(zhì)小囊泡一樣,外泌體可以懸浮于特定密度梯度的蔗糖中,其密度范圍1.13g/ml-1.21g/ml,將要分離外泌體的樣本液體置于梯度蔗糖介質(zhì)上,隨后通過離心將外泌體分離。此法獲得的外泌體純度較高,但步驟繁瑣,耗時(shí),對(duì)離心時(shí)間極為敏感。具體步驟是:收集培養(yǎng)2d的上清液。將培養(yǎng)上清液先以1500r/min離心5min除去細(xì)胞及碎片,再依次以1000×g離心10min取上清,10000×g離心30min取上清,然后用100ku超濾離心管(Millipore)濃縮至15mL,外泌體表面有其特異性標(biāo)記物,用包被抗標(biāo)記物抗體的磁珠與外泌體囊泡孵育后結(jié)合。
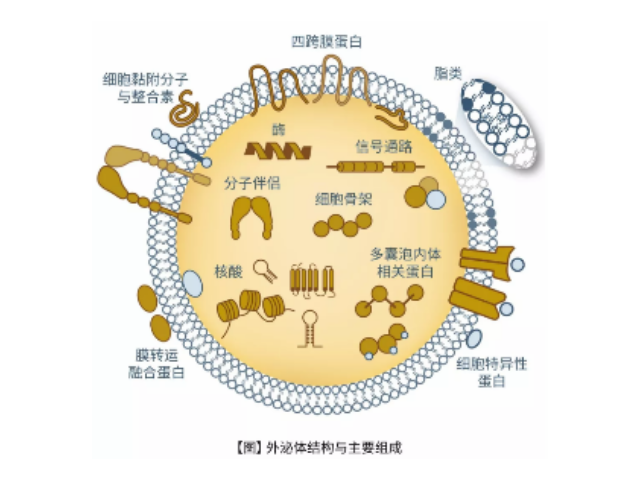
外泌體:已經(jīng)有研究報(bào)道了各種Hh的胞外轉(zhuǎn)運(yùn)機(jī)制,但實(shí)際用于體內(nèi)Hh分泌和轉(zhuǎn)運(yùn)的途徑尚不清楚。該研究顯示Hh在果蠅翅膀成蟲盤的分泌依賴于運(yùn)輸所需的內(nèi)體分選復(fù)合物(ESCRT)。在體內(nèi),產(chǎn)生Hh的細(xì)胞中ESCRT活性的降低導(dǎo)致外部細(xì)胞表面保留Hh。此外,產(chǎn)生Hh的細(xì)胞中的ESCRT活性對(duì)于長距離信號(hào)傳導(dǎo)是必需的。證據(jù)表明Hh和ESCRT蛋白質(zhì)的庫在體內(nèi)一起分泌到細(xì)胞外空間中,并且隨后可以在受體細(xì)胞的表面一起被檢測(cè)到。這些發(fā)現(xiàn)揭示了ESCRT蛋白質(zhì)在控制形態(tài)發(fā)生活性中的新功能,揭示了一種新的機(jī)制,通過細(xì)胞外囊泡在組織中轉(zhuǎn)運(yùn)分泌的Hh,這是長距離靶向誘導(dǎo)所必需的。超離法是常用的外泌體純化手段,采用低速離心、高速離心交替進(jìn)行,可分離到大小相近的囊泡顆粒。珠海正規(guī)外泌體提取試劑供應(yīng)商
外泌體提取:超濾膜也可用于分離外泌體。北京外泌體提取試劑廠家推薦
研究初次發(fā)現(xiàn)瘧原蟲傳染小鼠血漿外泌體(exosomes)能夠壓制一些病癥血管生成,并初步闡明其分子機(jī)制。研究加深了對(duì)瘧原蟲傳染宿主所分泌的外泌體與一些病癥血管生成之間的相互作用的認(rèn)識(shí),為開發(fā)瘧原蟲傳染來源的外泌體作為一種新型抗一些病癥制劑奠定了基礎(chǔ)。研究人員選用肺病小鼠模型作為研究對(duì)象,從傳染瘧原蟲的小鼠血漿中獲得外泌體,并將這些外泌體注射到小鼠的一些病癥內(nèi)部,并與沒有瘧原蟲傳染的小鼠血漿外泌體進(jìn)行對(duì)照。研究發(fā)現(xiàn),瘧原蟲傳染小鼠的血漿外泌體明顯壓制一些病癥血管的生成。進(jìn)一步的研究發(fā)現(xiàn),瘧原蟲傳染的小鼠血漿外泌體通過至少四種特殊的微小RNA(miR16-5p/17-5p/322-5p/497-5p)壓制血管內(nèi)皮細(xì)胞VEGF受體(VEGFR2)的表達(dá)從而阻斷血管生成的信號(hào)通路。這些發(fā)現(xiàn)加深了人們對(duì)瘧原蟲抗病機(jī)理的理解,并為瘧原蟲療法治病一些疾病的臨床研究提供進(jìn)一步的理論依據(jù)。北京外泌體提取試劑廠家推薦
作為一種分子通斷開關(guān)的KRAS發(fā)生突變時(shí)會(huì)處于“開啟”狀態(tài)。在80%~95%的胰腺導(dǎo)管腺病(PDAC)當(dāng)中,這個(gè)基因發(fā)生突變,這也是這種一些疾病中較為常見的突變。這些研究人員證實(shí)iExosome能夠運(yùn)送特異性地靶向KRAS的siRNA和shRNA分子,并且比他們的合成對(duì)應(yīng)物脂質(zhì)體(liposome)更加高效。脂質(zhì)體不具有外泌體表現(xiàn)出的天然復(fù)雜性和優(yōu)勢(shì)。德州大學(xué)MD安德森一些疾病中心一些疾病生物學(xué)助理教授ValerieLeBleu博士說,“我們的研究提示著與脂質(zhì)體相比,外泌體表現(xiàn)出運(yùn)送siRNA分子和壓制侵襲性胰腺瘤生長的優(yōu)異能力。我們也證實(shí)外泌體表面上的CD47存在允許它們躲避來自循環(huán)單核細(xì)胞...
- 徐州外泌體提取試劑單價(jià) 2025-07-15
- 武漢正規(guī)外泌體提取試劑廠家 2025-07-15
- 鄭州正規(guī)外泌體提取試劑哪家便宜 2025-07-15
- 貴陽外泌體提取試劑哪里買 2025-07-15
- 廣州正規(guī)外泌體提取試劑產(chǎn)品介紹 2025-07-15
- 南京外泌體提取試劑單價(jià) 2025-07-14
- 唐山外泌體提取試劑供應(yīng)商 2025-07-14
- 南昌正規(guī)外泌體提取試劑廠家 2025-07-14
- 寧波外泌體提取試劑廠家直銷 2025-07-14
- 武漢正規(guī)外泌體提取試劑哪里買 2025-07-14
- 成都正規(guī)外泌體提取試劑廠家現(xiàn)貨 2025-07-14
- 北京外泌體提取試劑供應(yīng)商 2025-07-14
- 重慶正規(guī)外泌體提取試劑生產(chǎn)廠家 2025-07-14
- 長沙外泌體提取試劑產(chǎn)品介紹 2025-07-14
- 貴陽外泌體提取試劑產(chǎn)品介紹 2025-07-13
- 珠海外泌體提取試劑哪家便宜 2025-07-13


- 蘇州正規(guī)細(xì)胞外基質(zhì)膠廠家直銷 07-15
- 寧波成都細(xì)胞外基質(zhì)膠 07-15
- 南昌正規(guī)細(xì)胞外基質(zhì)膠廠家推薦 07-15
- 武漢正規(guī)外泌體提取試劑廠家 07-15
- 開封細(xì)胞外基質(zhì)膠價(jià)格 07-15
- 鄭州正規(guī)外泌體提取試劑哪家便宜 07-15
- 貴陽外泌體提取試劑哪里買 07-15
- 長沙無血清細(xì)胞凍存液廠家推薦 07-15
- 唐山細(xì)胞外基質(zhì)膠單價(jià) 07-15
- 溫州唐山細(xì)胞外基質(zhì)膠 07-15