- 產地
- 蘇州
- 品牌
- 外泌體提取試劑
- 型號
- 齊全
- 是否定制
- 是
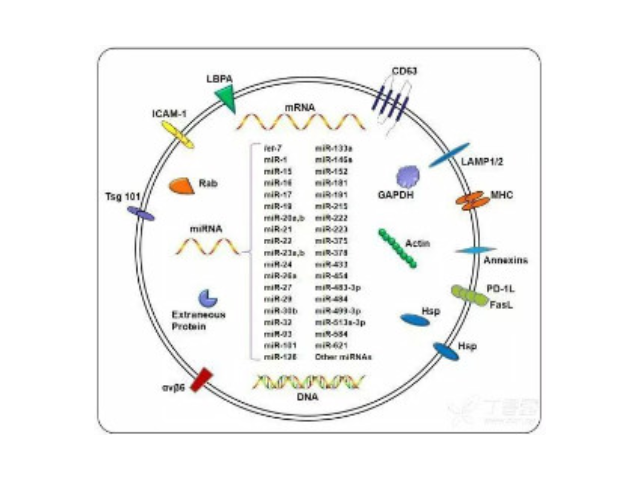
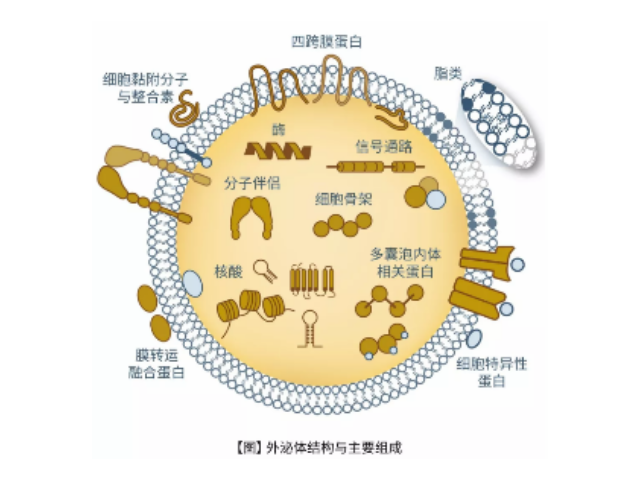
外泌體(Exosome)是由細胞分泌而來的微小囊泡,直徑約為30-200nm,密度在1.13-1.21g/ml,具有杯狀形態、雙層膜結構,天然存在于血液、尿液、唾液、母乳和細胞培養基等生物體液中。包括瘤細胞在內幾乎所有類型的細胞(免疫細胞、神經細胞、干細胞),都可以產生并釋放exosome。Exosome內含有與細胞來源相關的蛋白質rRNA和microRNA,Exosome可通過細胞膜受體直接受體細胞,也可運輸蛋白質、mRNA、miRNA、lncRNA、circRNA,甚至細胞器進入受體細胞,參與細胞間通訊。Exosome在免疫應答、炎癥反應、血管生成、凋亡、凝血和廢物處理等生理過程發揮關鍵作用,不同細胞來源的exosome所含有的RNA和蛋白成分不盡相同,可作為多種疾病的早期診斷標記物,也能作為靶向藥物的載體進行疾病如何高效地提取外泌體是實現這項新興液體活檢技術臨床常規化應用的關鍵。上海外泌體提取試劑廠家直銷

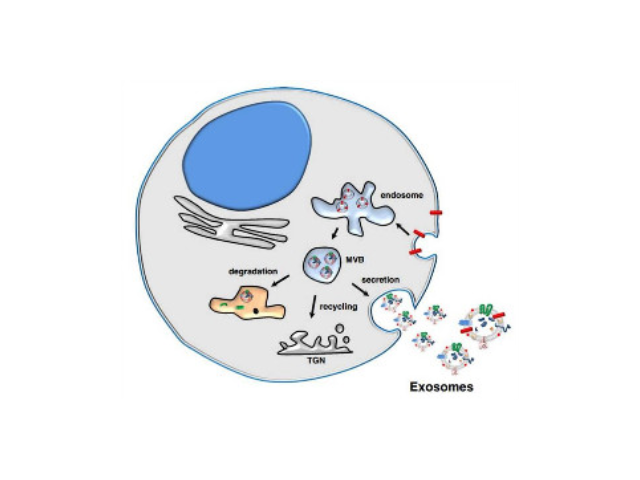
目前的主流觀點認為,外泌體的產生過程為:細胞膜內陷,形成內體(endosome),再形成多泡體(multivesicularbodies,MVB),較后分泌到胞外成為外泌體。外泌體中攜帶有母細胞的多種蛋白質、脂類、DNA和RNA等重要信息。外泌體較早見于1981年,EGTrams等在體外培養的綿羊紅細胞上清液中發現了有膜結構的小囊泡,并命名為exosome。對于外泌體的作用,當時推測為細胞排泄廢物的一種方式。1996年GRaposo等發現類似于B淋巴細胞的免疫細胞也會分泌抗原呈遞外泌體(antigenpresentingvesicle),所分泌的外泌體可以直接刺激效應CD4+細胞的抗一些病癥反應。2007年HValadi等進一步發現細胞之間可以通過外泌體中RNA交換遺傳物質。隨著有關外泌體研究越來越多,研究者發現它普遍參與了機體免疫應答、抗原呈遞、細胞分化、一些病癥生長于侵襲等各種生物過程中。目前人們多采用超速離心、免疫磁珠、超濾、沉淀或試劑盒等方法實現外泌體的提取分離。鄭州正規外泌體提取試劑廠家在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。
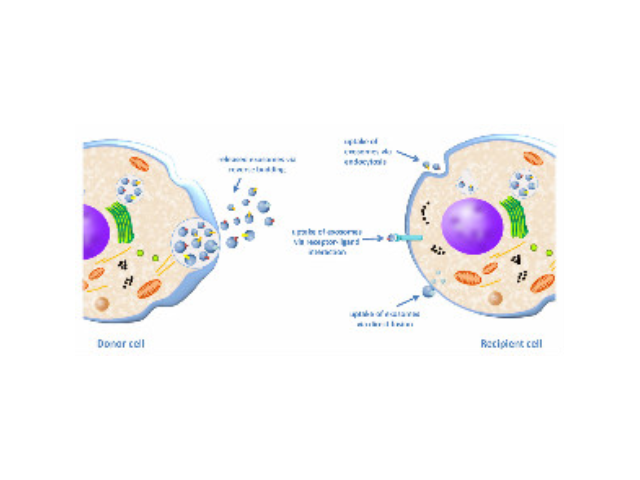
人體幾乎所有類型的細胞都能分泌外泌體,外泌體普遍存在并分布于各種體液中,攜帶多種蛋白質、mRNA、miRNA和脂質類物質等,作為重要的傳遞信號分子,形成了一種全新的細胞-細胞間信息傳遞系統,可參與細胞通訊、細胞遷移、血管新生和一些病癥細胞生長等過程。外泌體與微泡:我們知道,細胞間相互作用可以通過釋放蛋白質、核酸、脂質等分子到胞外與受體結合從而介導胞內細胞傳導。除此之外,細胞還可以釋放膜囊泡,外泌體與微泡就是其中兩種,二者相似但形成方式不同:外泌體是細胞內內溶酶體微粒內陷形成的多囊泡體,經多囊泡體外膜與細胞膜融合后釋放到胞外基質中的膜囊泡,而微泡則是細胞出芽與細胞膜融合后直接脫落形成的囊泡,且外泌體大小均一,直徑在40~100nm,其大小取決于其起源部位以及細胞中的脂質雙層結構;而微泡大小不一,直徑在50~1000nm之間。唐山正規外泌體提取試劑產品介紹在超速離心力作用下,使蔗糖溶液形成從低到高連續分布的密度階層,是一種區帶分離法。
外泌體的提取方法:1、色譜法。色譜法是利用根據凝膠孔隙的孔徑大小與樣品分子尺寸的相對關系而對溶質進行分離的分析的方法。樣品中大分子不能進入凝膠孔,只能沿多孔凝膠粒子之間的空隙通過色譜柱,首先被流動相洗脫出來;小分子可進入凝膠中絕大部分孔洞,在柱中受到更強地滯留,更慢地被洗脫出。分離到的外泌體在電鏡下大小均一,但是需要特殊的設備,應用不普遍。2、超濾離心。由于外泌體是一個大小約幾十納米的囊狀小體,大于一般蛋白質,利用不同截留相對分子質量(MWCO)的超濾膜對樣品進行選擇性分離,便可獲得外泌體。超濾離心法簡單高效,且不影響外泌體的生物活性,是提取細胞外泌體的一種新方法聚乙二醇(PEG)可與疏水性蛋白和脂質分子結合共沉淀。
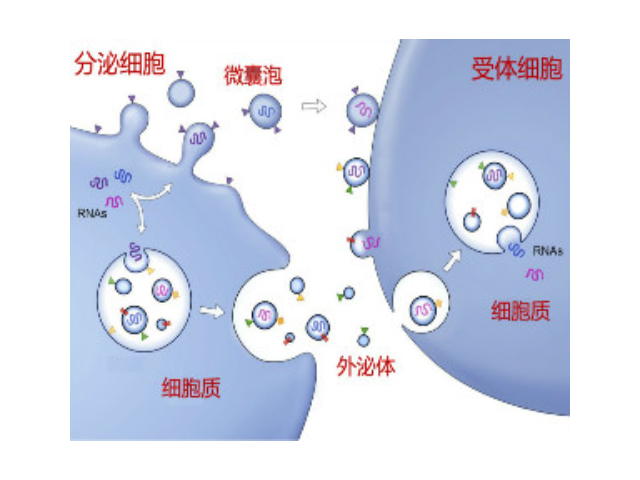
用于外泌體提取的體液收集注意事項:1、選擇血清還是血漿?推薦大多數研究選擇血漿。血液凝固過程中血小板會產生大量外泌體,含量占血清中外泌體的50%以上,選擇血漿可避免不必要的影響。2、注意抗凝劑的選擇。肝素類抗凝劑與PCR假陰性有關,這可能是因為肝素與引物和/或酶有競爭作用。除了克制PCR,肝素可以與外泌體結合,阻止細胞攝取外泌體。因此需要記錄肝素類藥物的患者的血液樣本。EDTA和雙嘧達莫(CTAD),CTAD可以阻止血小板的并克制其釋放外泌體。EDTA可能會干擾PCR反應(盡管其程度小于肝素),但是還是優于其他選擇。此外,有研究表明鈣螯合劑可在體外促進外泌體與血小板的結合從而降低經EDTA、或檸檬酸鹽處理后的血液樣本中外泌體的表觀數量。多聚物沉淀法早先應用于從血清等樣本中收集病毒,現在也被用來沉淀外泌體。武漢正規外泌體提取試劑哪家好
對外泌體的研究興趣日益增長,無論是研究其功能還是了解如何將其用于微創診斷的開發。上海外泌體提取試劑廠家直銷
研究探討了外泌體是否可以作為RNAi的有效載體的可能性。與脂質體和其他合成藥物納米顆粒載體不同,外泌體含有可能增強內吞作用的跨膜和膜錨定蛋白,從而促進其內容物的遞送。CD47是外泌體蛋白質之一,是一個普遍表達的整合素相關跨膜蛋白,其部分功能可以保護細胞免受吞噬作用。CD47是信號調節蛋白α(SIRPα,也稱為CD172a)的配體,CD47-SIRPα間的結合能夠發出“不要吃我”的信號,從而壓制吞噬作用。病基因RAS能夠促進胰腺病細胞增殖,增強胞飲作用從而促進一些病癥細胞攝取外泌體。合成納米顆粒對細胞有一定毒性作用,但使用外泌體能夠較小化對細胞的毒性。研究人員發現,CD47和病基因KRAS驅動的胞飲作用都會壓制外泌體被循環系統的清理,并增強胰腺病細胞對外泌體的特異性。所以,外泌體的這種特性增強了它們通過遞送RNAi來特異性靶向胰腺病中的KRAS的能力,并且使用外泌體作為單一靶向劑顯著改善了所有實驗PDAC小鼠模型的總生存期。上海外泌體提取試劑廠家直銷
作為一種分子通斷開關的KRAS發生突變時會處于“開啟”狀態。在80%~95%的胰腺導管腺病(PDAC)當中,這個基因發生突變,這也是這種一些疾病中較為常見的突變。這些研究人員證實iExosome能夠運送特異性地靶向KRAS的siRNA和shRNA分子,并且比他們的合成對應物脂質體(liposome)更加高效。脂質體不具有外泌體表現出的天然復雜性和優勢。德州大學MD安德森一些疾病中心一些疾病生物學助理教授ValerieLeBleu博士說,“我們的研究提示著與脂質體相比,外泌體表現出運送siRNA分子和壓制侵襲性胰腺瘤生長的優異能力。我們也證實外泌體表面上的CD47存在允許它們躲避來自循環單核細胞...
- 徐州外泌體提取試劑單價 2025-07-15
- 武漢正規外泌體提取試劑廠家 2025-07-15
- 鄭州正規外泌體提取試劑哪家便宜 2025-07-15
- 貴陽外泌體提取試劑哪里買 2025-07-15
- 廣州正規外泌體提取試劑產品介紹 2025-07-15
- 南京外泌體提取試劑單價 2025-07-14
- 唐山外泌體提取試劑供應商 2025-07-14
- 南昌正規外泌體提取試劑廠家 2025-07-14
- 寧波外泌體提取試劑廠家直銷 2025-07-14
- 武漢正規外泌體提取試劑哪里買 2025-07-14
- 成都正規外泌體提取試劑廠家現貨 2025-07-14
- 北京外泌體提取試劑供應商 2025-07-14
- 重慶正規外泌體提取試劑生產廠家 2025-07-14
- 長沙外泌體提取試劑產品介紹 2025-07-14
- 貴陽外泌體提取試劑產品介紹 2025-07-13
- 珠海外泌體提取試劑哪家便宜 2025-07-13


- 蘇州正規細胞外基質膠廠家直銷 07-15
- 寧波成都細胞外基質膠 07-15
- 南昌正規細胞外基質膠廠家推薦 07-15
- 武漢正規外泌體提取試劑廠家 07-15
- 開封細胞外基質膠價格 07-15
- 南京正規無血清細胞凍存液推薦廠家 07-15
- 鄭州正規外泌體提取試劑哪家便宜 07-15
- 貴陽外泌體提取試劑哪里買 07-15
- 長沙無血清細胞凍存液廠家推薦 07-15
- 唐山細胞外基質膠單價 07-15